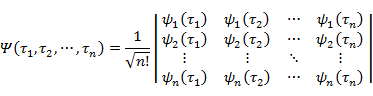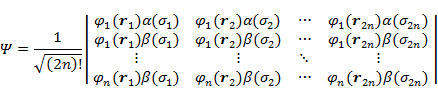7.3 Pauli の原理
Hartree 法では全波動関数を一電子波動関数の積で近似したが,電子のスピンを考慮すると,それでは不正確であることを以下に述べる。
多電子系における複数の電子のうち1つを特定して観測することは不可能であり,原理的に電子同士を区別することができない(粒子の同等性)。二電子系(ヘリウム原子)の全波動関数を Ψ とすると,|Ψ|2dτ は dτ に電子1,2を同時に見いだす確率をあらわす。電子1と2の座標をそれぞれ τ1,τ2 とすると,2つの電子が区別できないことから,
|
(7.3.1) |
である。さらに,電子は Fermi 粒子(スピン量子数が半整数)なので,2つの電子を交換したとき全波動関数の符号が変わらなければならないという制約がある。すなわち,
|
(7.3.2) |
の条件を満たさなければならない。6.2 節,6.3 節で,二電子系(ヘリウム原子)の全波動関数を一電子波動関数の積
|
(7.3.3) |
とおいて議論したが,(7.3.3) は (7.3.2) の条件を満たしていないことになる。また,6.2 節では2つの一電子波動関数をどちらも同じ水素類似原子の 1s 型軌道としているが,2つの電子が同じ軌道に入れるかどうかは実は自明のことではない(1s 型軌道のエネルギーが一番低いからという理由は考えられるが,ではリチウム原子のような三電子系の3個目の電子もやはり 1s 型軌道に入れるかというと,それは結論から言うとできない)。(7.3.2) の条件を満たすには,全波動関数を
|
(7.3.4) |
とおけばよい(N は規格化定数)。(7.3.4) で2つの一電子波動関数を同じにすると,
|
(7.3.5) |
となってしまうので,2つの電子が同じ一電子波動関数で表される状態をとることはない。スピンを考慮した一電子波動関数は,主量子数 n,方位量子数 l,磁気量子数 m,スピン磁気量子数 ms の4つの量子数で決まる。6.2 節では2つの電子がともに水素類似原子の 1s 型軌道に入るとしていたが,そのときはスピンを考慮していなかった。2つの電子は同じ n = 1,l = 0,m = 0 をもつがスピンが異なる(α と β)とすれば,矛盾はない。
Ψ の規格化条件より規格化定数を求めると,
|
(7.3.6) |
となり,二電子系の全波動関数は,
|
(7.3.7) |
となる(τ1,τ2 はスピン座標を含めた座標)
(7.3.7) を行列式で表現すると,
|
(7.3.8) |
となる。
これを n 電子系に拡張すると,全波動関数は
|
(7.3.9) | |
ただし, |
|
(7.3.10) |
となる(φi(ri) は波動関数の空間座標部分,α(σi) と β(σi) はスピン波動関数)。(7.3.9) の行列式を Slater(スレーター)行列式 という。
(7.3.10) を (7.3.9) に代入してスピンをあらわに表現すると,偶数個 2n の電子を含む原子の基底状態に対して次のような式が得られる。
|
(7.3.11) |
(7.3.11) の代わりに,簡便のために行列式の対角項だけを記述する場合もある。
|
(7.3.12) |
(7.3.9) または (7.3.11) の行列式は,一般的な行列式の性質から,波動関数の満たすべき要請
電子の交換(→列の交換)で Ψ の符号が変わる
ψi = ψj(→2つの行が一致)は Ψ = 0となるのでありえない
を満たしていることがわかる。2番目の要請を言い換えると,
|
2つの電子がスピンを含めて同じ一電子波動関数の示す状態をとることはない(4つの量子数 n,l,m,ms がすべて同じになることはない) |
となる。これを Pauli(パウリ)の排他原理 という。
Revised: 2007-07-27
スピン量子数が整数の粒子は Bose 粒子とよばれ,この場合は,粒子の交換で全波動関数の符号は変わらない。したがって,2つの Bose 粒子からなる系の全波動関数は (7.3.7) の − を + に置き換えたものになり,Pauli の原理の制限がない。
6.2 節でヘリウム原子の変分法について述べたが,(7.3.7) の形の全波動関数を用いても同じ結論となる。
全波動関数を (7.3.7) の形とおくと 6.3,7.1 節の Hartree 法は多少の修正が必要で,これは後で述べる。
Pauli の原理より,1つの軌道に入る電子の数は最大2個(α と β)という結論が得られる。