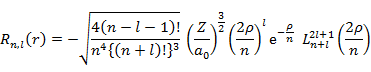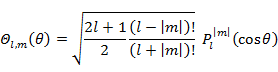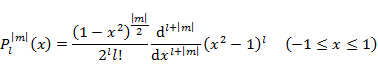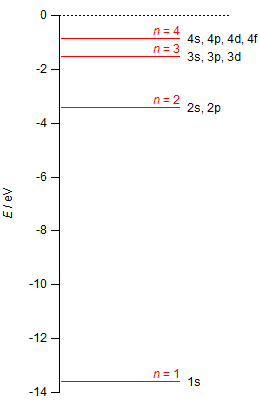5.4 水素類似原子の波動関数とエネルギー(2)
水素類似原子の電子波動関数 ψ
|
(5.4.1) |
主量子数 |
| 量子数 | 依存する関数 | 得られる情報 |
| 主量子数 n | Rn,l(r) | エネルギー,軌道の広がり |
| 方位量子数 l | Rn,l(r) と Yl,m(θ,φ) | 軌道角運動量の大きさ,軌道の形, (エネルギー) |
| 磁気量子数 m | Yl,m(θ,φ) | 軌道角運動量の z 成分 |
動径分布関数 Rn,l(r)
|
(5.4.2) |
Laguerre の陪多項式 |
(5.4.3) |
Laguerre の多項式 |
(5.4.4) |
|
(5.3.10) |
|
(5.3.11) |
球面調和関数 Yl,m(θ,φ)
|
(5.4.5) |
|
(5.4.6) |
Legendre の陪多項式 |
(5.4.7) |
|
(5.4.8) |
水素類似原子の電子エネルギー E
|
(5.3.14) |
|
電子エネルギー E は主量子数 n の値に応じて離散値を取る。主量子数 n をもつ ψ は n2 個あるので,エネルギーは n2 重に縮重していることになる。 (n,l,m) n = 1 n = 2 n = 3 |
|
電子エネルギー(Hamiltonian)![]() ,角運動量の2乗
,角運動量の2乗 ![]() およびその z 成分
およびその z 成分 ![]() の演算子は互いに可換であることから,電子波動関数 ψn,l,m が示す状態は,電子エネルギー,角運動量の2乗およびその z 成分が同時に確定値
の演算子は互いに可換であることから,電子波動関数 ψn,l,m が示す状態は,電子エネルギー,角運動量の2乗およびその z 成分が同時に確定値 ![]() ,
,![]() ,
,![]() をとる状態である。すなわち,次の (5.4.9) 〜 (5.4.11) は同時に成立する。
をとる状態である。すなわち,次の (5.4.9) 〜 (5.4.11) は同時に成立する。
|
(5.4.9) |
|
(5.4.10) |
|
(5.4.11) |
Revised: 2007-07-02
電子波動関数は軌道関数(orbital function)または軌道(orbital)ともよばれる。
方位量子数 l = 0, 1, 2, 3, ... の順にアルファベット s, p, d, f, ... で表記し,s 軌道,p 軌道などとよぶ。
エネルギーは (5.3.7) を解くことで得られるが,水素類似原子以外では,V(r) が単純なクーロンポテンシャルにならないので,一般にエネルギーは方位量子数 l にも依存する。
e = 1.6022 × 10-19 C
a0 = 5.2918 × 10-11 m
ε0 = 8.8542 × 10-12 F m-1
を用いて水素原子の 1s 軌道(Z = 1, n = 1)のエネルギーを計算すると,
E1s = -2.1799 × 10-18 J
である。
また,エネルギーを電子ボルト(eV;電気素量 e を単位とする)で表すと,
E1s = -13.61 eV
である。
![]()
(5.3.1) 参照
演算子の可換性については1.3節参照