CH3+ の分子軌道の構築
|
CH3+ の分子軌道(PM3 法により C2v 対称として計算) ※マウスドラッグで自由回転 |
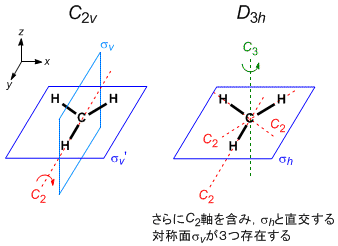
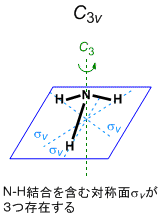
CH3+ は特に対称性に制限を加えずに構造最適化すると,D3h 対称構造(平面形)に収束する。考えやすくするため,以下の (A) ~ (C) のステップでは対称性による制限が緩い C2v 対称として考えることにする。
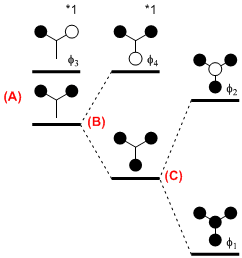
(A) 2つの水素の 1s 軌道の相互作用によって,それらの対称性軌道と反対称性軌道ができる。
(B) 3つめの水素の 1s 軌道は (A) の対称性軌道とのみ相互作用し,2つの新しい軌道ができる。(A) の反対称性軌道 φ3 と3つめの 1s 軌道の間の重なりはゼロなので相互作用なし。
*1 D3h 対称構造では,(A) の反対称性軌道 φ3 のエネルギー準位と (B) でできた反対称性軌道 φ4 のエネルギー準位は同じになる(縮重している)。
(C) 中心炭素の 2s 軌道は,(B) の対称性軌道とのみ有効な重なりをもち,2つの新しい軌道 φ1,φ2 ができる。
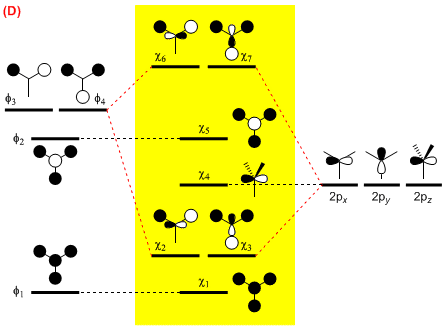
(D) 最後に,4つの s 軌道の組み合わせでつくられた4つの分子軌道 φ1 ~ φ4 と炭素の 2p 軌道の相互作用を考える。
φ1 と φ2 はどの 2p 軌道とも有効な重なりをもたない。φ3 は 2px 軌道と,φ4 は 2py 軌道とそれぞれ重なりをもち,新たな軌道を形成する。2pz 軌道は分子面に対し反対称であるが,φ1 ~ φ4 はすべて分子面に対して対称なので,いずれとも相互作用しない。
以上の操作で最終的に得られる分子軌道は下図の黄色の領域に記述した χ1 ~ χ7 である。
以上の議論は CH3+ に限ったことではない。
CH3+ は価電子を6個もつので,χ2,χ3 が HOMO(縮重している),χ4 が LUMO
BH3 は CH3+ と等電子数なので,HOMO,LUMO は CH3+ と同様
NH3 は価電子を8個もつので,χ4 が HOMO,χ5 が LUMO
H3O+,CH3– は NH3 と等電子数なので,HOMO,LUMO は NH3 と同様
ただし,NH3,H3O+,CH3– では,χ4 に電子が入る結果,分子の形は平面形(D3h)よりもピラミッド形(C3v)のほうが安定になる。D3h から C3v に変化したときに各分子軌道のエネルギー準位がどう変化するかを定性的に示したのが下図である。
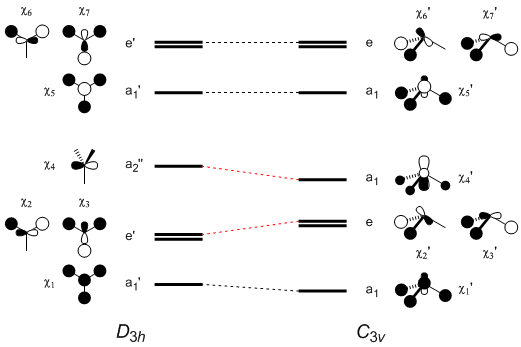
- C3v 対称構造では,χ4 と χ5 の対称性が同じになり互いに混じり合うことができる
χ4 には χ5 が同位相で少し混じる → χ4 のエネルギー準位は下がる
χ5 には χ4 が逆位相で少し混じる → χ5 のエネルギー準位は一旦上がるが,3つの水素の 1s 軌道が同位相で接近することによる安定化と相殺される - χ1 では,3つの水素の 1s 軌道が同位相で接近することによる安定化に加え,χ4 との相互作用による安定化もわずかにある
- χ2,χ3 では,水素の 1s 軌道同士が逆位相で接近するので不安定化(水素の 1s 軌道と中心原子の 2p 軌道の間の同位相重なりが小さくなることでも不安定化)
- χ6,χ7 では,水素の 1s 軌道同士が逆位相で接近することによる不安定化と,水素の 1s 軌道と中心原子の 2p 軌道の間の逆位相重なりが小さくなることによる安定化が相殺する
どの軌道が HOMO,LUMO になるかで分子の形が D3h(平面形)か C3v(ピラミッド形)かが決まる。
最大ハードネスの原理
HOMO—LUMO 間のエネルギー差が大きいほど分子は安定
- χ3 まで電子が入っている場合は,D3h(平面形)
- CH3+,BH3 - χ4 まで電子が入っている場合は,C3v(ピラミッド形)
- NH3,H3O+,CH3–
|
H3O+ の分子軌道(PM3 法により C3v 対称として計算) ※マウスドラッグで自由回転 |